Laboratorio de química:
Objetivos:
OBJETIVOS
- - Por medio de este programa hacer que los estudiantes realicen laboratorios de acuerdo a lo visto en clase
- - Aprender de una forma didáctica, y no peligrosa , como hacer diferentes compuestos utilizando los implementos y sustancias de un verdadero laboratorio
- - Con los diferentes actividades realizadas, identificábamos
- ¿Que es DISOCIACION?
- ¿que es un ácido?¿que es una base?
- Identificarlos, saber sus características y como se forman
- ¿Que es la lluvia ácida?¿como se forma?
- La quema de combustibles fósiles, etc.
MARCO TEÓRICO
JUSTIFICACION
Mediante yenka, crearemos laboratorios virtuales, que se acercan a la realidad gracias a este ingenioso programa TIC , pondremos en practica lo aprendido y obtendremos conceptos nuevos, YENKA es un programa creado para fisica y quimica, es un programa muy facil de entender y pondremos a prueba lo que hemos aprendido sin tener peligro de reaccionar mal un compuesto etc.
MARCO TEORICO INGRESANDO A YENKA
Primer tema: Ácidos, Bases y Sales.
Acido: Es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7. Esto se aproxima a la definición moderna de Johannes Nicolaus Brønsted y Thomas Martin Lowry, quienes definieron independientemente un ácido como un compuesto que dona un catión hidrógeno (H+) a otro compuesto (denominado base).
Bases: Es cualquier sustancia que presente propiedades alcalinas. En primera aproximación (según Arrhenius) es cualquier sustancia que en disolución acuosaaporta iones OH− al medio. Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
KOH → OH− + K+ (en disolución acuosa)
Los conceptos de base y ácido son contrapuestos.
Sales: Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más agua, lo que se denomina neutralización.
Hidroxido de Sodio: (NaOH) o hidróxido sódico, también conocido como soda cáustica o sosa cáustica, es un hidróxido cáustico usado en la industria (principalmente como una base química) en la fabricación de papel, tejidos, y detergentes.
En el cuadro podemos notar que es una base ya que aparecen iones OH.
Es muy corrosivo y ácido. Se emplea comúnmente como reactivo químico y se trata de un ácido fuerte que se disocia completamente en disolución acuosa.
Podemos notar que es un ácido porque contiene H+

Pongamos en práctica lo que aprendimos:
Solución 1:
Es un ácido ya que presenta H+, la solución 1 no es una base.
La solución 2, es una base ya que presenta notamos que presenta un OH.
La solución 2 es la respuesta.
Pero probemos la solución 3.
Efectivamente la solución es la solución número 2, ya que esta, es un ácido presenta H+
Aprendimos a diferenciar una sal de una base, y las supimos identificar.
Segundo Laboratorio:
Lluvia Ácida
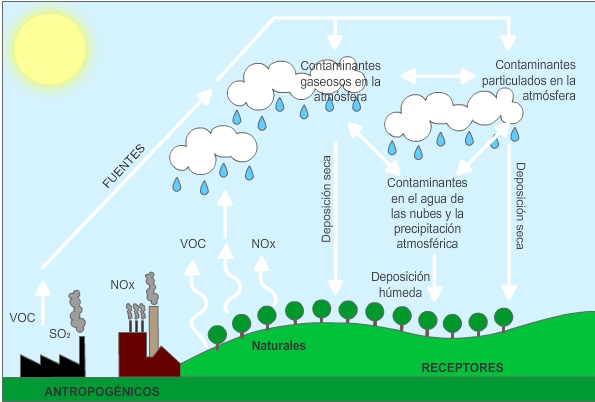
La lluvia ácida es una de las consecuencias de la contaminación del aire. Cuando cualquier tipo de combustible se quema, diferentes productos químicos se liberan al aire. El humo de las fábricas, el que proviene de un incendio o el que genera un automóvil, no sólo contiene partículas de color gris (fácilmente visibles), sino que ademas poseen una gran cantidad de gases invisibles altamente perjudiciales para nuestro medio ambiente.
Centrales eléctricas, fábricas, maquinarias y coches "queman” combustibles, por lo tanto, todos son productores de gases contaminantes. Algunos de estos gases (en especial los óxidos de nitrógeno y el dióxido de azufre) reaccionan al contacto con la humedad del aire y se transforman en ácido sulfúrico, ácido nítrico y ácido clorhídrico . Estos acidos se depositan en las nubes. La lluvia que producen estas nubes, que contienen pequeñas partículas de acido, se conoce con el nombre de "lluvia ácida".
Es la forma cuando la humedad en el aire se combina con los óxidos de nitrógeno, el dióxido de azufre y el trióxido de azufre emitidos por fábricas, centrales eléctricas, calderas de calefacción y vehículos que queman carbón o productos derivados del petróleo que contengan azufre. En interacción con el agua de la lluvia, estos gases forman ácidos nítricos, ácido sulfuroso y ácido sulfúrico. Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo la lluvia ácida.
La repuesta es la B, la piedra caliza cambia de color, antes tenía una tonalidad gris, y se convirtió en blanco.
Consecuencias de la lluvia acida: Al aumentar la acidez de las aguas de ríos y lagos, produce trastornos importantes enla vida acuática.Algunas especies de plantas y animales logran adaptarse a las nuevascondiciones para sobrevivir en la acidez del agua, pero otras no.
La lluvia ácida también aumenta la acidez de los suelos, y esto origina cambios en la composición de los mismos, produciéndose la lixiviación de importantes nutrientes para las plantas (como el calcio) e infiltrando metales tóxicos, tales como el cadmio, níquel, manganeso, plomo,mercurio, que de esta forma se introducen también en las corrientes de agua. La vegetación sufre no sólo las consecuencias del deterioro del suelo, sino también un daño directo
Conclusiones segundo laboratorio: Aprendimos cómo y por qué se da la lluvia acida, y sus efectos en el ecosistema.

























No hay comentarios:
Publicar un comentario